此篇主要翻譯自MIT開放課程計畫的電化學能量系統。這堂課中,主要給予電化學單元的運作綜觀,並定義電化學單元討論中常見的名詞術語。
1. 電化學單元與其運作
法拉第反應Faradaic Reaction:有關電荷傳輸的電化學反應。
電化學單元Eletrochemical Cell:涉及電荷傳輸的兩個半反應,其中由電解質(傳遞離子)和外部電路(傳遞電子)連接。
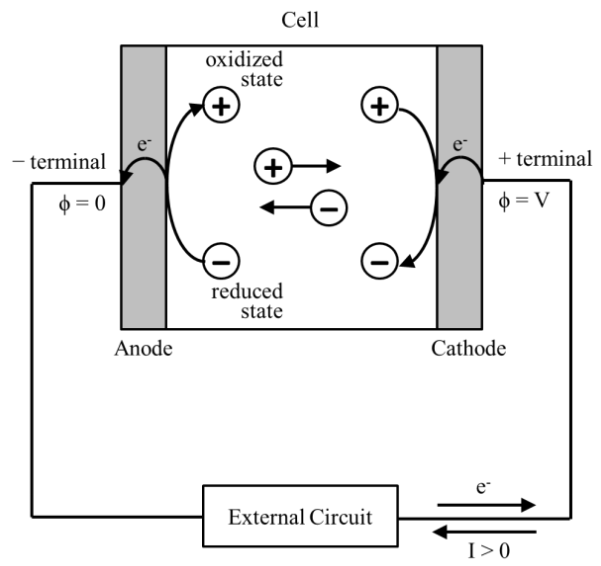
在運作的伽凡尼電池中,電子和離子自發地流動,將化學能轉換為電能(和熱)。如同圖1所示,在伽凡尼電池中,氧化作用在陽極發生並產生電子。另一方面,在陰極還原作用發生,並在電極表面消耗電子。因電子無法在電解質中移動,故他們經過外部電路由陽極Anode前往陰極Cathode,產生電流由陰極流往陽極。在電解質中,氧化物質分別由陽極遷往Migrate陰極,而還原物質等電量地由陰極遷往陽極,兩者移動的淨值分別為陰/陽極還原/氧化的量。在電解單元Electrolytic Cell中,電荷以相反方向移動,由電位能較高的壓差驅動,並把電能以化學能形式處存。一般習慣以伽凡尼電池的外部電流為正;因此以電解單元運作來說,電流便為負值。
以下為電化學單元構造的兩個範例:
範例1: PEM燃料電池
| 陽極 | H2(g)→2H++2e– |
| 陰極 | 0.5O2(g)+2e–→H2O(l) |
| 淨反應 | H2(g)+0.5O2(g)→H2O(l) |
| 電解質 | polymer electrolyte membrane (PEM) |
範例2: 鋰離子電池
| 陽極 | LiC6→Li++e–+C6 |
| 陰極 | Li++e–+CoO2→LiCoO2 |
| 淨反應 | LiC6+CoO2→LiCoO2+C6 (“搖椅電池”) |
| 電解質 | 含有LiPF6鹽類的有機溶劑 |
2. 等效電路
電化學單元有可能表達為一等效電路。在這門課程稍後,我們將會學習如何以等效電路基礎電路元件表示電化學單元。現今,我們利用可代表一電化學單元的等效電路,來說明其電路行為。
一個伽凡尼單元可用以下等效電路表示:
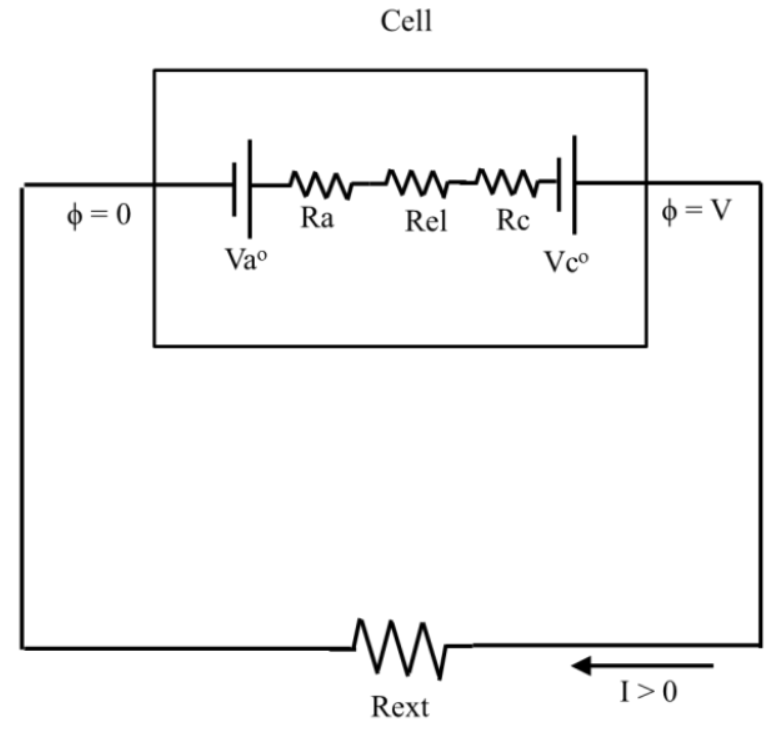
| Vao | 陽極的標準平衡半電池電位 |
| Vco | 陰極的標準平衡半電池電位 |
| Ra | 陽極的介面阻抗 |
| Rc | 陰極的介面阻抗 |
| Rel | 電解質阻抗 |
| Rext | 外部電路阻抗 |
同樣地,我們可以再簡化等效電路透過集結電路元件以達成較少的代表性元件。
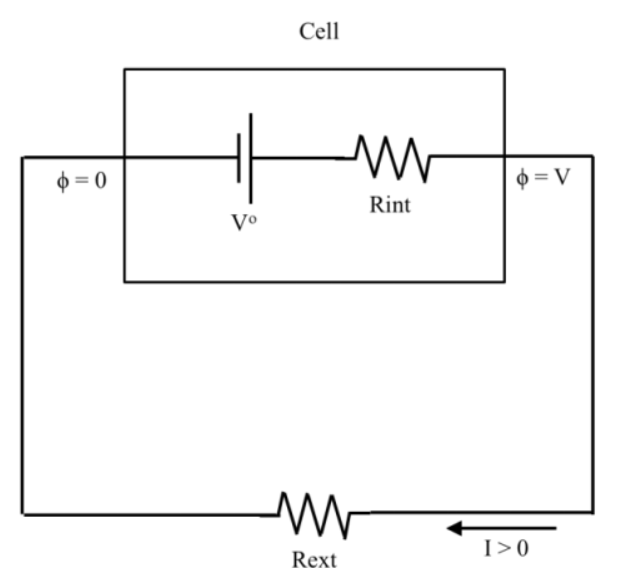
| Vo=Vco-Vao | 電池的開路電壓(OCV) |
| Rint=Ra+Rel+Rc | 內阻 |
值得注意的是標準平衡半電池電位(Vao和Vco)在電化學中經常寫作Eo,但為了避免和電場混淆所以改寫。標準平衡半電池電位可以為正或負,只要對伽凡尼單元來說,開路電壓OCV為正值即可。
根據克西荷夫定理,
V = IRext = Vo = IRint
其中V是電池電壓。電池電壓是電流I、充電狀態Q(將在課程3詳細定義)與其他電化學變數的函數。電池電壓 – 以熱力學來說 – 指單位電荷轉移帶來的淨電池反應之自由能差距。熱力學的詳細解析會在課程7中介紹。
V(I, Q,…) = △G/ne = [淨反應的自由能差]/[傳遞的電荷]
當外部電路阻抗為零時,我們可以得到短路電路電流short circuit current:
Is = Vo / Rint
當得到電流和電池電壓時,我們可以計算電池功率P,剛好等於單位時間內所作的電功:
P = IV
假設內阻為定值,相依電流的電池電壓和電池功率可為以下圖片繪製:
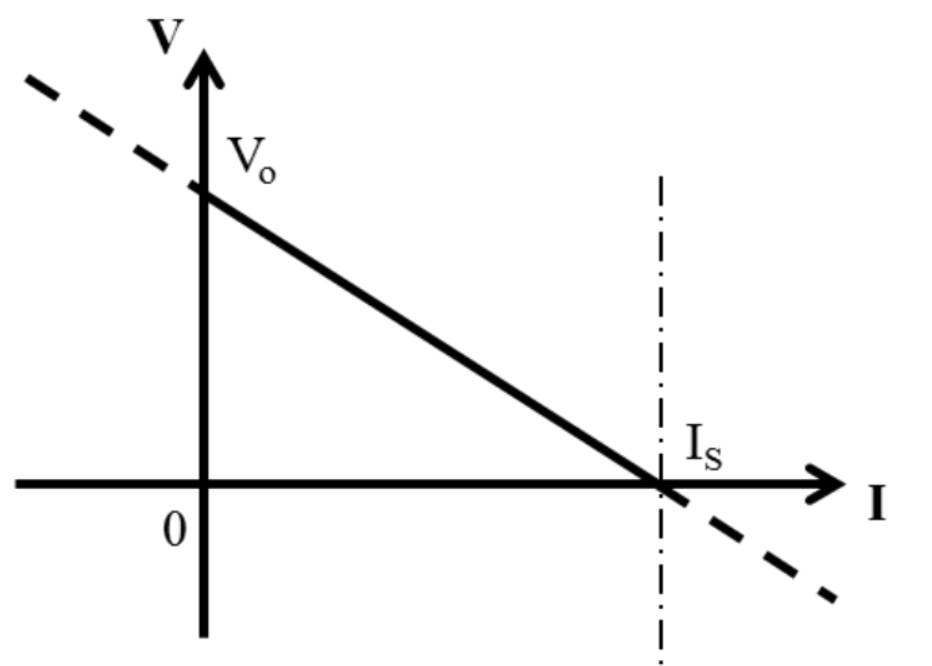
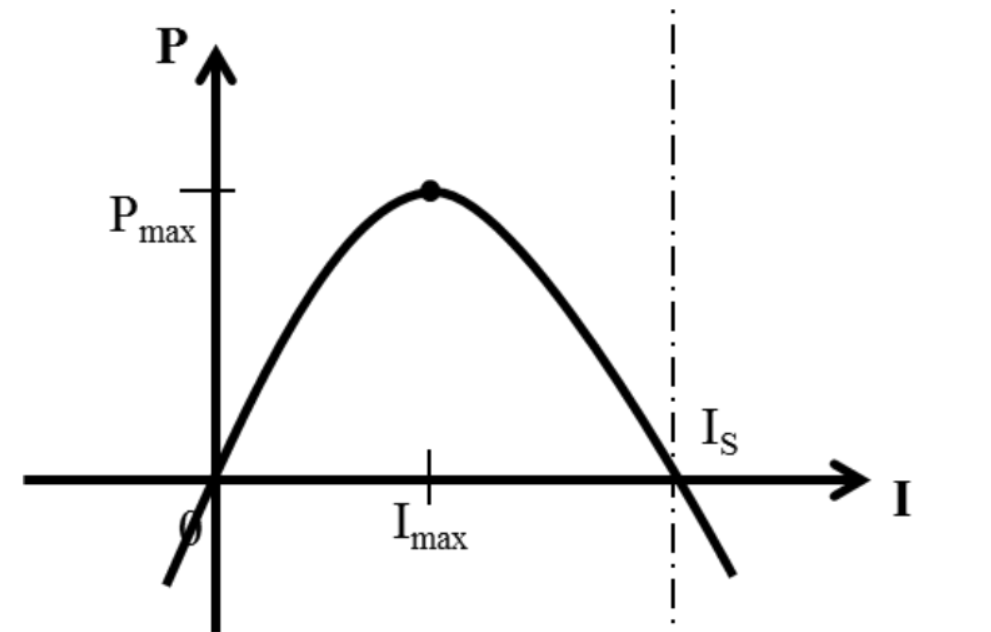
| 電解區域 Electrolytic Regime | 伽凡尼區域 Galvanic Regime | 超伽凡尼區域 Super Galvanic Regime |
| P<0 I<0 V>Vo | P>0 I>0 0<V<Vo | P<0 I>Is V<0 |
| 電能→化學能儲存 | 化學能→電能+熱損 | 化學能+電能→熱損 |
| 透過與電池電壓相反電壓 幫鋰離子電池充電 | 透過一外部負載 讓電池放電 | 加載一外部電壓強迫 電池以快於Is速度放電 |
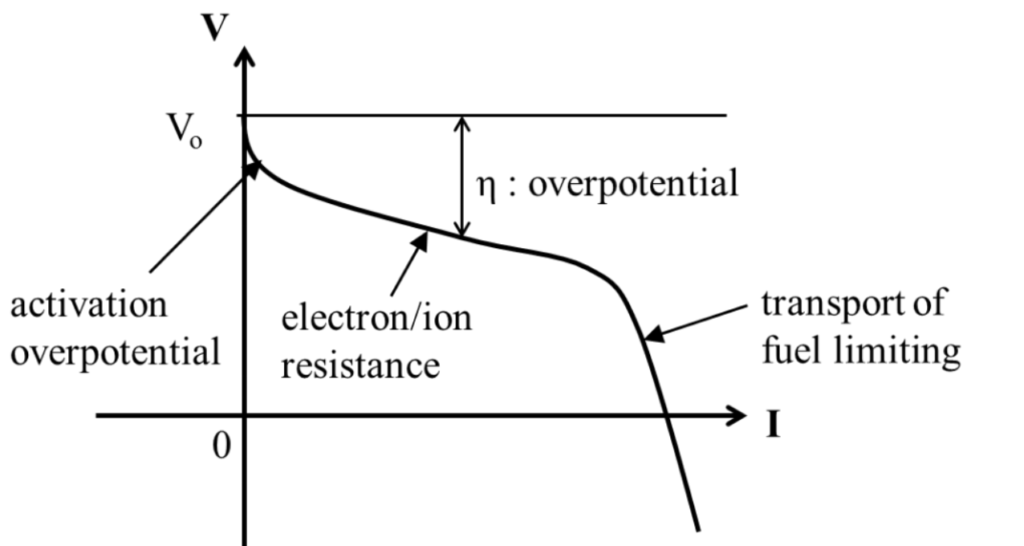
比較真實的燃料電池並無固定內阻。實際上,非線性的電位能下降由許多元件的過電位Overpotential所組成。過電位是指電流經過不同路徑阻抗所引起的電位能下降量。我們將在此課程學習其行為和解析。
多數的燃料電池中,電池電壓隨電流而改變。在電流較小時,啟動過電位Activation Overpotential主導開始時的曲線凹型。緊接著,來自電子或離子傳遞的阻抗變成一限制因素Limiting Factor. 最後,當電流夠大時,電池燃料的傳遞無法支撐電流,使電壓快速地下降。