本篇主要是按照Lacey, Matt網站上Transport and transference in battery electrolytes [1],試著按照其洞見所著。同時也參照Andreas, Nyman的博士論文[2],並穿插於其間。不過此篇的transport, transference皆為臨時翻譯,我也會在其後加註原文方便辨識。
如同另一篇所述,鋰離子電池透過充放電的大小主要受兩條路徑限制:
- 經過外部電路的電子流,電流傳遞:由電位梯度驅動
- 經過電解液(質)及隔離膜的離子流,質量傳遞:由濃度梯度驅動
這兩者的差異有個專有名詞叫做極化,來自電學與化學(機械)之間反應速度差異。依據維基百科[3],極化是指集體性的(電化學)機械副作用,可能會在電極和電解液介面產生隔離性阻礙。
舉例來說,若有天你的鋰離子電池個人3C產品充放電速度受限;非常有可能就是因離子的傳遞速度較慢,使得功率受到限制。
目錄
傳送現象及傳送數 Transport Number
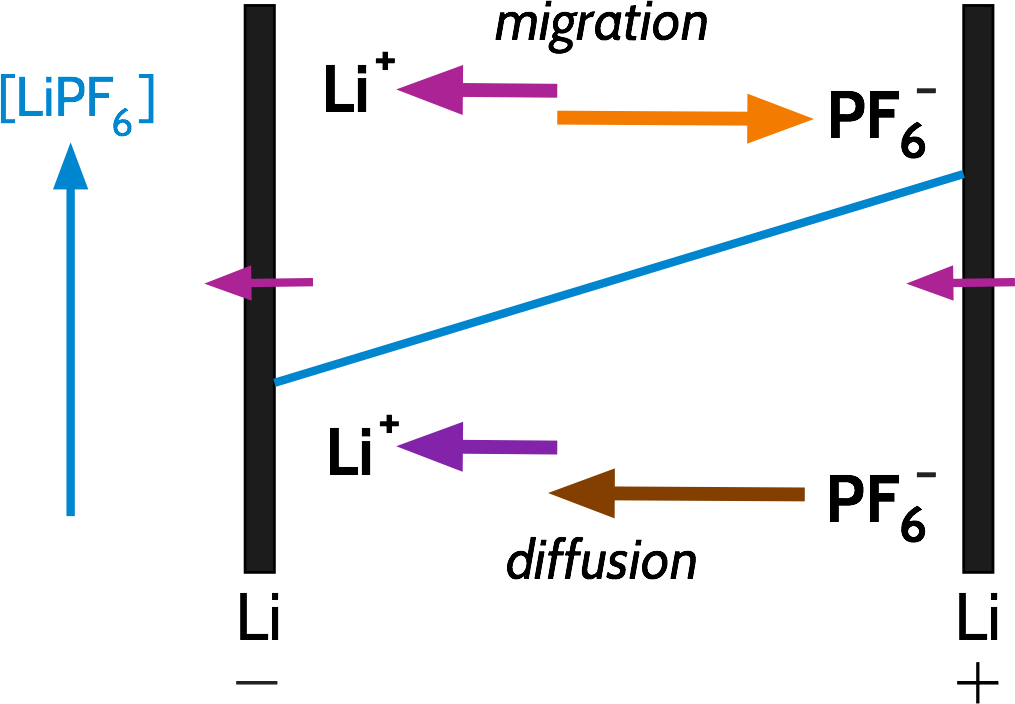
假設現今有一鋰離子電池,其電解質中的鹽類為LiPF6並完全分解於溶劑中。當電池放電時 – 即陽離子Li+由負/陽極遷往正/陰極 – 部分的電解液電流由Li+攜帶,而其餘由PF6–反向攜帶,如下圖:
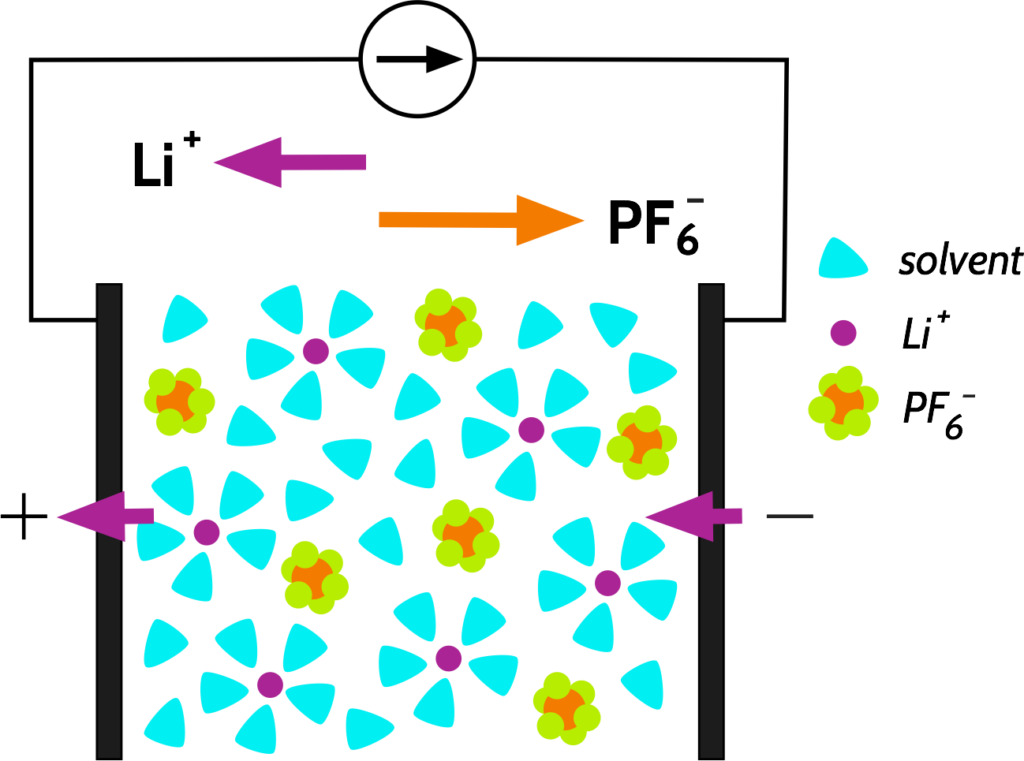
我們習慣上將同類型陰、陽離子攜帶的電流分量稱作傳送數 Transport Number, 以PF6–, Li+來說便分別是t–, t+. 普遍鋰離子電池t+多為0.3左右。事實上,傳送數 Transport Number是指離子中電子移動率mobilities的比率,以能斯特-愛因斯坦方程式可寫為和移動率Mobolities μ、離子導電率Ionic Conductivities σ、擴散係數Diffusion Coefficients D的關係:
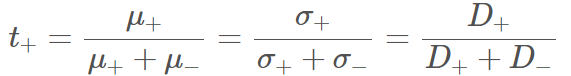
一般來說,t+會比t–小;主要是因為不協調(non-coordinating, 或弱協調)的陰離子比較容易在電解液中自由地移動;而難以移動的鋰(陽)離子需要拖著巨大的溶劑殼移動,或是被緊密地固定在聚合物電解質骨架上。
回到電池,因只有一部份的電流是由鋰離子移動承載,而鋰在負/陽極脫嵌或在正/陰極嵌入速度快於電遷移Migration的補充。透過鋰的脫嵌與嵌入,造成了鋰鹽LiPF6的濃度梯度並驅動鋰鹽的擴散;也補足了鋰離子電遷移以外的移動(transport.)
此一濃度梯度的形成極可能會限制電池的充電或放電速度。假如在電極表面的鋰鹽濃度接近零,會使離子阻抗極大並使電池停擺。若鋰鹽濃度太高,則鋰鹽很可能會一同沉澱,也會使離子阻抗過大。(儘管這些反應在長時間下是可逆的)
傳送數t+的數值大小以及鋰鹽的擴散係數,決定濃度梯度的形成速度,也決定了該電池電解質能支撐的電流大小(假若沒有其他條件限制)。除了離子導電率外,此二者均為任何電解質的重要屬性。理想上,t+等於一,也就是說t–為零;亦即陰離子完全無法動彈。若真為上述情形,也無法形成濃度梯度。
測量 t+: Bruce-Vincent方法
最常用來在聚合物電解質中測量傳送數t+的實驗方法稱為Bruce-Vincent方法,是由Colin Vincent和Peter Bruce共同執行的研究並發表於1987年(此處及此處)
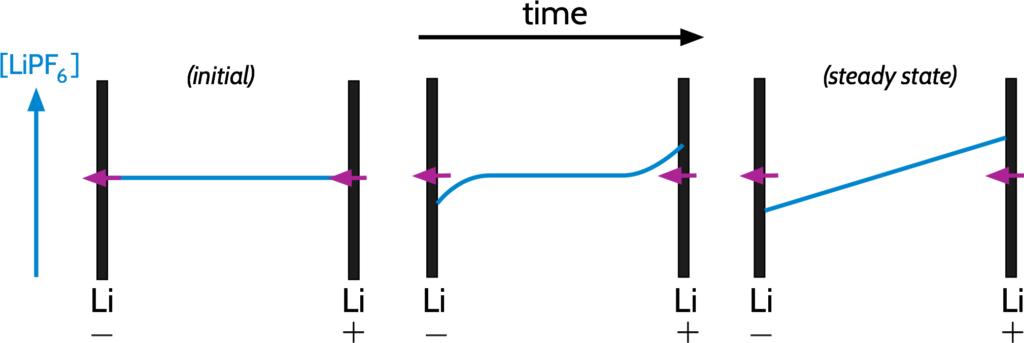
此方法運用了對稱實驗單元(亦即使用兩個鋰金屬電極的電化學實驗單元)中的極化現象。其中兩電極的電位能差距極小,致使濃度梯度亦有限。直到系統達成穩態後,即濃度梯度不隨時間而改變,如下圖:
此方法假設電解質中的離子均完美地解離。更精確地說,這些電解質完全遵守能斯特-愛因斯坦方程,呈現如下式離子導電率(或電子移動率)與擴散係數關係:
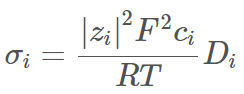
在此狀況中,假設其為完美系統,電流最初僅與系統的導電率及電位能差相關ΔV:
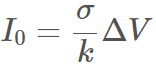
其中k代表統常數,例如電極距離與表面積之比例。在穩態中,濃度梯度並不隨時間變化。陰離子的電遷移,完整地被擴散反方向平衡掉。(即為,陰離子的淨流量為零 ,因陰離子在電極表面被阻擋)同時,鋰離子所攜帶的電流50:50由電遷移和擴散組成。
參考文獻
- Lacey, Matt, Transport and transference in battery electrolytes, http://lacey.se/science/transference/
- Nyman (2011). An Experimental and Theoretical Study of the Mass Transport in Lithium-Ion Battery Electrolytes, http://kth.diva-portal.org/smash/record.jsf?pid=diva2%3A392067&dswid=4861
- Wikipedia, Polarization (electrochemistry), https://en.wikipedia.org/wiki/Polarization_(electrochemistry)